Wissenschaftler der Aarhus University haben mit einer japanischen Forschungsgruppe zusammengearbeitet, um die Struktur eines entscheidenden Enzyms – der sogenannten Natrium-Kalium-Pumpe – zu ergründen, die einen Teil jeder Zelle des menschlichen Körpers darstellt. Das Ergebnis wurde kürzlich im Journal Nature veröffentlicht und könnte den Weg für ein besseres Verständnis von neurologischen Erkrankungen ebnen.
Sie ist für das bloße Auge nicht sichtbar und man kann sie nicht spüren, aber bis zu 40 Prozent der Energie unseres Körpers fließen in die mikroskopische Natrium-Kalium-Pumpe, um sie mit der benötigten Energie zu versorgen. Die Pumpe macht in jeder Zelle aller Menschen und Tiere fortwährend ihre Arbeit. Sie funktioniert ähnlich wie eine kleine Batterie, die neben anderen Dingen das Natrium-Gleichgewicht aufrechterhält, welches äußerst wichtig für das Funktionieren von Muskeln und Nerven ist.
Die Natrium-Kalium-Pumpe transportiert in einem festen Kreislauf Natrium aus der Zelle heraus und Kalium in sie hinein. Während dieses Prozesses ändert sich die Struktur der Pumpe. Es ist gut bekannt, dass die Pumpe eine Natrium- und eine Kaliumform besitzt. Aber die strukturellen Unterschiede zwischen den beiden Formen waren ein Rätsel und Forscher konnten nicht erklären, wie die Pumpe Natrium von Kalium unterscheidet.
Struktur löst das Rätsel
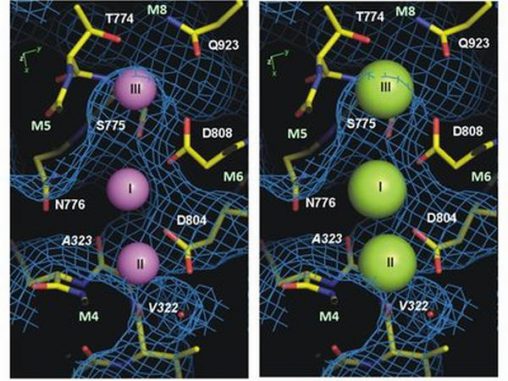
In den Jahren 2007 und 2009 nahmen Wissenschaftler der Aarhus University an einer Forschungsarbeit teil, die zur Strukturbeschreibung der kaliumgebundenen Form des Proteins führte. Dank der internationalen Zusammenarbeit zwischen Professor Chikashi Toyoshimas Gruppe an der University of Tokyo und der Aarhus University wurde jetzt auch die Struktur der natriumgebundenen Form des Proteins beschrieben. Erstmals können die Natriumionen in einer so hohen Auflösung (0,28 Nanometer) untersucht werden, dass die Forscher tatsächlich beobachten können, wo sich die Natriumionen in der Struktur der Pumpe binden.
„Die neue Proteinstruktur zeugt, wie die kleineren Natriumionen gebunden und anschließend aus der Zelle heraus transportiert werden, wohingegen der Zugriff der etwas größeren Kaliumionen blockiert wird. Wir verstehen jetzt, wie die Pumpe auf molekularer Basis zwischen Natrium und Kalium unterscheidet. Das ist ein großer Schritt nach vorn für Forschungsprojekte über Ionenpumpen und könnte uns helfen, neurologische Leiden zu verstehen und zu behandeln, die mit Mutationen der Natrium-Kalium-Pumpe zusammenhängen. Dazu gehören eine Form von Parkinsonismus und die alternierende Hemiplegie im Kindesalter, wo das Anbinden des Natriums gestört ist“, erklärte Bente Vilsen, eine Professorin an der Aarhus University, die gemeinsam mit dem außerordentlichen Professor Flemming Cornelius die Aktivitäten des Projekts vor Ort leitete.
Durch die präzise Lokalisierung der Natriumionen und indem sie zeigen, wie die Pumpe Natrium bindet, demonstrieren die neuen Ergebnisse, dass die Aarhus University nach wie vor an der Spitze dieses Forschungsgebietes steht. Neben der neuen Studie wurde kürzlich ein Science-Bericht über die Struktur der Natrium-Kalium-Pumpe veröffentlicht.
Ein beeindruckter Nobelpreisträger
Die lebenswichtige Pumpe wurde 1957 von Professor Jens Christian Skou von der Aarhus University entdeckt, der für seine Entdeckung 1997 den Nobelpreis bekam. Das neue Ergebnis ist eine Summe aus fünf oder sechs Jahrzehnten der Forschung, die auf den Mechanismus hinter diesem grundlegenden Zellmotor gerichtet war.
„Vor Jahren, als die ersten Elektronenmikroskop-Aufnahmen des Enzyms gemacht wurden und es bei 250.000-facher Vergrößerung nur ein millimetergroßer Punkt war, fragte ich mich, wie man jemals in der Lage sein würde, die Struktur des Enzyms aufzudecken. Die Pumpe transportiert Kalium in die Zellen hinein und Natrium aus ihnen heraus, also muss sie imstande sein, zwischen den beiden Ionen zu unterscheiden. Aber bis jetzt war es ein Rätsel, wie das möglich ist“, sagte der emeritierte Professor Jens Christian Skou. Skou bleibt auch im Alter von 94 Jahren noch auf dem neuesten Stand, was neue Entwicklungen auf dem Gebiet betrifft, das er vor mehr als 50 Jahren ins Leben rief.
„Jetzt haben die Forscher die Struktur beschrieben, die es dem Enzym erlaubt, Natrium zu identifizieren und das könnte den Weg für ein genaueres Verständnis über die Funktionsweise der Pumpe bereiten. Es ist eine beeindruckende Leistung und etwas, von dem ich nicht einmal zu träumen gewagt habe“, sagte Jens Christian Skou.
Abhandlung in Nature: „Crystal structure of a Na+-bound Na+, K+-ATPase preceding the E1P state„
(THK)
Antworten