Fünfzig Jahre nachdem Wissenschaftler erstmals eine Frage über die Proteinfaltung formulierten, hat die Suche nach Antworten zu der Erschaffung eines eigenständigen Forschungsgebietes geführt, das wichtige Fortschritte bei Supercomputern, neuen Materialien und der Entdeckung von Medikamenten erzielte und unser Verständnis der grundlegenden Prozesse des Lebens gestaltete, so genannte „Proteinfaltungs-Erkrankungen“ wie Alzheimer, Parkinson und Typ-II-Diabetes eingeschlossen.
In einem Artikel, der am 23. November 2012 im Journal Science veröffentlicht wurde, prüften Forscher der Stony Brook University den Fortschritt hinsichtlich eines 50 Jahre alten Rätsels, das als das Proteinfaltungsproblem bekannt ist. Ken Dill und Justin MacCallum vom Louis and Beatrice Laufer Center for Physical and Quantitative Biology zeigen, wie sich eine Gemeinschaft aus Forschern aufmachte, um ein herausforderndes Problem der fundamentalen Wissenschaft anzugehen, das zu der Zeit keinen offensichtlichen Nutzen hatte.
„Proteinfaltung ist wesentliche, fundamentale Wissenschaft. Es gibt kein bestimmtes kommerzielles Ziel, trotzdem sind die begleitenden Ergebnisse umfassend und tief“, berichteten die Forscher in ihrer Abhandlung „The Protein Folding Problem, 50 Years On„.
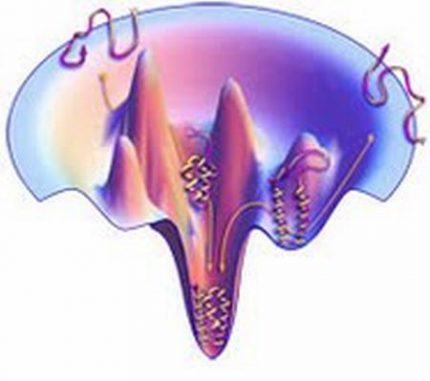
„Wir haben gelernt, dass sich Proteine schnell falten, weil zufällige thermale Bewegungen Konformationsänderungen verursachen, die – energetisch gesehen – abwärts an der ursprünglichen Struktur führen – ein Prinzip, das in trichterförmigen Energielandschaften festgehalten wird. Und auch dank der großen Protein-Datenbank mit bekannten Strukturen ist die Vorhersage von Proteinstrukturen jetzt deutlich erfolgreicher als es in den frühen Tagen für möglich gehalten wurde. Was vor einem halben Jahrhundert mit drei fundamentalen wissenschaftlichen Fragen begann, hat sich jetzt in das eigenständige Forschungsgebiet der Physik von Proteinen entwickelt.“
Video-Link: https://youtu.be/kkmaSr-ufu0
Kurzer Überblick über die Geschichte des Proteinfaltungsproblems. (Stony Brook University)
Dieses Jahr markiert das 50. Jubiläum des Nobelpreises für Chemie, der 1962 an Max Perutz und John Kendrew ging. Sie erhielten ihn für ihre bahnbrechende Arbeit über die Bestimmung der Struktur globulärer Proteine. Diese Arbeit legte den Grundstein für die strukturelle Biologie, die biologische Mechanismen bezüglich der Struktur von Proteinen und anderen Biomolekülen auf molekularer Ebene interpretiert. Ihre Arbeit warf außerdem die Frage auf, wie Proteinstrukturen durch physikalische Prinzipien erklärt werden [können].
Seit Perutz und Kendrew die Struktur zweier Proteine erkannten, wurden fast 80.000 Proteinstrukturen entdeckt. Das Proteinfaltungs-„Problem“ ergab sich, als Perutz und Kendrew nicht imstande waren zu verstehen, wie die gefaltete Struktur des Protein-Moleküls mit dessen Sequenz zusammenhängt. Seitdem gab es ein reges Interesse daran, den Proteinfaltungs-„Code“ zu verstehen: Wie führt eine gegebene Kette von Aminosäuren zu einer speziellen, zusammengeballten („ursprünglichen“) Struktur eines Proteins?
Proteine sind Moleküle, die die grundlegenden Funktionen in biologischen Zellen ausführen – von der Umwandlung von Nahrung in Wachstum über die Reparatur von DNA-Molekülen und beschädigten Zellbereichen und die Bewegung in Muskeln bis zur Übertragung von Signalen im Gehirn und Licht im Auge. Menschen besitzen ungefähr 20.000 verschiedene Typen von Protein-Molekülen. Jedes erfüllt eine andere Funktion. Die Fähigkeiten von Proteinen, ein derart breites Spektrum leistungsfähiger chemischer Funktionen auszuführen, entstehen aus einem merkwürdigen Prinzip aus chemischer Struktur und Funktion, nämlich der Faltung jedes Proteins. Ein Protein ist eine winzige Kette aus Kügelchen – wie eine Perlenkette -, in der die kugelähnlichen Bestandteile Aminosäuren genannt werden. Aminosäuren gibt es in 20 verschiedenen Typen. Das Faltungsprinzip besteht darin, dass unterschiedliche Sequenzen von Aminosäuren verschiedene Protein-Moleküle dazu bringen, sich auf sehr spezifische aber andere Weisen zusammenzuballen, was ihre sehr verschiedenen Funktionalitäten zur Folge hat.
Video-Link: https://youtu.be/DDHYIReVPr0
Schematische Darstellung der Faltung eines Proteins entlang seiner Energielandschaft. (C. Fennell, Laufer Junior Fellow)
Das Proteinfaltungs-Problem wurde zu einer Zusammenstellung dreier, miteinander verbundener Rätsel: Was ist der Faltungscode? Wie findet das Protein in Bruchteilen einer Sekunde seine eine ursprüngliche Struktur innerhalb der Zelle (das Nadel-im-Heuhaufen-Problem)? Und: Können wir eine Computermethode erstellen, die neue Proteinstrukturen aus der großen Anzahl von Aminosäure-Sequenzen ableiten kann, die momentan noch nicht bekannt sind?
Dill, Direktor des Laufer Center und angesehener Professor für Physik und Chemie, und MacCallum, ein Junior-Mitarbeiter am Laufer Center, beschreiben, wie an allen drei Fronten große Fortschritte gemacht wurden. Sie besprechen detailliert einige sehr wichtige Nebenergebnisse dieser Arbeit, die zur damaligen Zeit völlig unerwartet waren. Dazu gehören die Entwicklung des IBM Blue Gene Computers und verteiltes Rechnen, computerbasierte Methoden für die Entdeckung neuer Pharmazeutika, ein tieferes Verständnis molekularer Mechanismen in der Biologie, ein tieferes Verständnis der atomaren Interaktionen innerhalb von Proteinen (woran auch Carlos Simmerling, David Green und Rob Rizzo vom Stony Brook Laufer Center beteiligt waren) und eine neue Klasse sehr vielversprechender Polymere namens „Foldamere“.
Dill und MacCallum erörtern, dass das, was als eine beherrschende Frage der grundlegenden Wissenschaft begann, jetzt zu einem ganzen Gebiet theoretischer und experimenteller Ansätze geworden ist, in dem viele Fragen zu wenigen Antworten und noch mehr Fragen führen.
(THK)
Antworten